E continuamos nossa conversa, o gênio da latinha de óleo e eu:
– Legal, então me conta o que a entropia tem a ver com o que você está dizendo: tempo, universo, morte, como é isso?
– Bem, vamos relembrar que em processos irreversíveis – que geralmente são espontâneos – acontecendo em sistemas isolados a entropia só pode aumentar. Só é zero em um processo reversível, e todos os processos reais são irreversíveis, portanto…
– Mas existem processos reversíveis; gelo por exemplo. Colocado numa mesa vira água, esfrio o ambiente e vira gelo.
– Sim é reversível, mas se espontâneo ou não depende da temperatura e pressão. De gelo para água é processo espontâneo em temperaturas acima de zero graus centígrados. Agora, para esfriar o ambiente abaixo de zero preciso exercer trabalho sobre o sistema – ele precisa estar em uma geladeira conectada à tomada. Daí não é processo espontâneo, né?
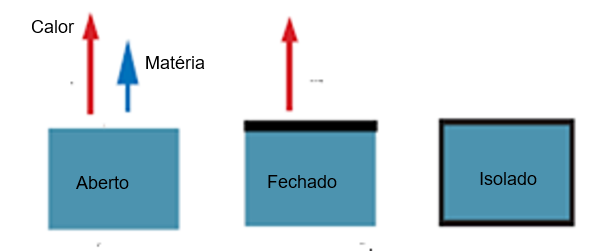
As três condições de um sistema, com relação a calor e matéria
– Tá, mas e a questão do universo?
– No início, matéria e energia estavam dispersas homogeneamente no espaço; não havia núcleos de matéria ou diferenças de energia. Com o esfriamento matéria e energia, ajudadas pela gravidade, iniciam a coalescer em pontos cada vez mais densos formando estrelas e planetas.
– Matéria e energia?
– Tanto faz: Einstein com a equação mais famosa do mundo mostrou que E = m c2, onde E e m são respectivamente energia e matéria e c a velocidade da luz,
– Ah, sim. Mas qual a entropia do universo nesse início?
– Meu amo, essa é uma questão ainda cheia de mistério, não completamente resolvida pelas melhores mentes. Veja, além de poder realizar qualquer desejo seu tenho a capacidade de, em segundos, rever todo o conhecimento humano e colocá-lo aos seus pés. Mas quando esse conhecimento é insuficiente ou contraditório eu não posso fazer nada. De qualquer modo, pensando num sistema com dispersão homogênea de massa e energia pode-se aventar que esse sistema – o universo – iniciou num estado de baixa entropia. Não há desordem, que aparecerá depois.
– Certo, e com o tempo o que acontece?
– O universo inicia a esfriar e energia é transferida de um número infinito de lugares para um número infinito de outros lugares. Lugares quentes são as estrelas e frios os planetas. Na terra, estamos sujeitos à transferência de energia do sol, e há tantas outras fontes de energia que pode ser transferida e gerar trabalho: a geotérmica, que utiliza o calor do centro da terra, depósitos de carvão, petróleo e combustíveis nucleares. Também há diferenças de temperatura na atmosfera, daí ventos que tocam hélices de geradores elétricos. Com o tempo essas fontes de energia são consumidas, o universo tende a uma equalização da temperatura, e a entropia aumenta. Quando isso acontece diminui a quantidade de energia utilizável para gerar trabalho.
– Tem uma coisa que não entendo: para mim equalização significa ordem, mas você diz que a entropia aumenta com a equalização de temperatura no universo.
– É preciso entender bem o conceito de desordem, que não é tão simples assim. Por exemplo meu amo; se lhe apresento dois copos, um com água e o outro com pedaços de gelo, qual dos dois aparenta maior desordem? Pois não é aquele com gelo, apesar de o senhor tê-lo apontado. A água quando congelada o faz adotando uma forma cristalina ordenada, como esta figura aqui. Na fusão o cristal se desfaz e as moléculas de água são livres para se movimentar. Enfim, muitas vezes é a nível microscópico que o sistema revela ser ordenado ou desordenado.

Cristal de gelo
Se o aumento de entropia do universo causado pelo aumento de desordem lhe parece difícil de entender, meu amo, pense no aumento causado pela equalização de calor. Imagine um sistema composto por uma barra de cobre transferindo calor de um bloco de ferro quente a outro de ferro frio. Vamos lembrar da equação fundamental vista no post anterior: dS = Q / T, onde S = entropia, Q = calor, T = temperatura, na qual inserimos os dados da figura:
bloco quente: variação de S = (- 4000 / 600) = – 6,66 sinal menos por que o calor está saindo do bloco quente
bloco frio: variação de S = (+ 4000 / 250) = + 16,0
somando: varuação total de S = = – 6,66 + 16,0 = + 9,34
Esse o valor do aumento de entropia em volta desse sistema. Agora multiplique isso por um bilhão, um trilhão ou muito mais de estrelas trocando calor e energia com outras e com planetas e terá o aumento de entropia do universo.
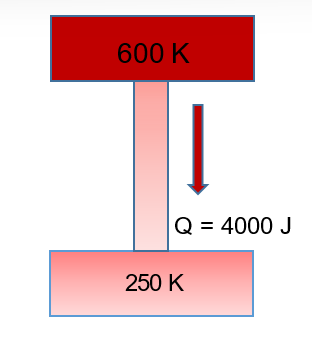
Barra de cobre conduzindo calor de fonte quente para reservatório frio
– Eu não entendo uma coisa: por que o aumento de entropia diminui a disponibilidade para produzir trabalho. E outra: por que em cálculos a temperatura é sempre dada neste tal de K e não em graus centígrados.
– K significa Kelvin e eu já disse que é o valor em graus centígrados mais 273, mas desculpe amo, eu disse mas não expliquei. É que se utilizarmos graus centígrados, a zero graus a famosa equação dS = Q / T daria uma divisão por zero; dS seria infinito o que é impossível.
Com o aumento de entropia do universo, a energia se torna mais difusa, deixa de haver diferenças de energia e calor, a temperatura no espaço tende a um só valor o que limita a transformação de calor em trabalho pois o calor não pode mais circular no espaço. Tudo, processos biológicos, mecânicos, térmicos e nucleares é retardado, seguindo-se daí a morte térmica quando a entropia atingir seu valor máximo.
– Puxa, como é importante essa tal de entropia
– Sim meu amo. Ela também dá a direção do tempo e diz-se que a entropia é a flecha do tempo. Não se perguntou porque o tempo corre sempre do passado em direção ao futuro? Por exemplo, suponha um vídeo mostrando um copo que cai de uma mesa. Ele se despedaça, cobrindo o chão de fragmentos com tamanhos e formas diferentes. Vamos agora rodar o vídeo no sentido oposto, e veremos os pedaços de vidro se aproximarem e refazerem o copo que sobe até a mesa. Seria possível isso?
– Não, queda e rompimento do copo são eventos irreversíveis.
– Muito bem meu amo, eventos irreversíveis em sistemas isolados sempre causam aumento de entropia, e é esse aumento que determina o passar do tempo. Outra maneira de dizer a mesma coisa é: “o aumento de desordem e de entropia distinguem o passado do futuro, dando assim uma direção ao tempo”.
– Que mais?
– Entropia tem a ver com informação. Como posso explicar isso … Ah sim. Veja meu amo o senhor já sabe que em um sistema qualquer, resfriado até quase zero Kelvin – que em centígrados é quase 273 graus abaixo de zero – todas as moléculas estão quase imóveis. A entropia é mínima e a ordem é máxima. Portanto não há incerteza sobre a posição das moléculas, que no caso é o que queremos saber. O grau de conhecimento é máximo, a informação é máxima e a entropia é mínima. Quando isso acontece não há alternativas, sabe-se tudo. Ao contrário, em alta temperatura temos alta entropia, alta desordem e todas as posições são possíveis; não sabemos nada definitivo sobre o sistema. Pergunta: a estrutura A é resistente sob cargas? Resposta: ah sim, muito. Essa é uma resposta com alta entropia, pois desordenadamente inclui qualquer carga que pode ser considerada “alta”. Há um monte de possibilidades, logo pouquíssima informação.
– Mas para que serve relacionar entropia com informação?
Muita coisa; existem modelos matemáticos que realizam a correlação entropia versus número de possibilidades e com isso conseguem quantificar numericamente a incerteza, complexidade e aleatoriedade de sistemas e eventos. Isso é essencial para otimizar processos e tomar decisões baseadas em grande número de dados, como em inteligência artificial por exemplo.
– Obrigado por toda essas informações, gênio mas chega de entropia. Agora gostaria de expressar um desejo
– Às ordens
– Quero ganhar na MegaSena
– Não consigo. Teria que acertar 6 entre 60 números. Isso dá 50.063.860 combinações possíveis. É muita entropia!

